Các nhà nghiên cứu từ Trung tâm Ung thư Abramson của Penn Medicine cho biết, một chất ức chế phân tử nhỏ tấn công đột biến gen gây ung thư KRAS, được tìm thấy trong gần 30% tất cả các khối u ở người, đã thu nhỏ thành công các khối u hoặc ngăn chặn sự phát triển của ung thư trong các mô hình ung thư tuyến tụy tiền lâm sàng. Điều đó cho thấy loại thuốc này là một ứng cử viên sáng giá cho các thử nghiệm lâm sàng. Nghiên cứu được công bố trên tạp chí Cancer Discovery, một tạp chí của Hiệp hội Nghiên cứu Ung thư Hoa Kỳ.
“Kết quả của nghiên cứu này hoàn toàn trái ngược với bất cứ điều gì chúng ta đã thấy trước đây về bệnh ung thư tuyến tụy,” đồng tác giả cao cấp Ben Stanger, MD, Tiến sĩ, Giáo sư Hanna Wise về Nghiên cứu Ung thư tại Trường Y khoa Perelman tại Đại học Y khoa Perelman cho biết. Đại học Pennsylvania và giám đốc Trung tâm Nghiên cứu Ung thư Tụy Penn: “Ngay cả trong các mô hình nghiên cứu tiền lâm sàng cho loại ung thư này, hầu hết các loại thuốc được thử nghiệm trong thập kỷ qua – bao gồm cả các liệu pháp miễn dịch mới – đều có tác động hạn chế.”
Bệnh nhân ung thư tuyến tụy có tiên lượng xấu tổng thể với tỷ lệ sống sót sau 5 năm là 11% và các lựa chọn điều trị hạn chế. Gần 90 phần trăm bệnh ung thư tuyến tụy là do đột biến gen KRAS, gen gây ung thư phổ biến nhất trong các loại ung thư. Liệu pháp nhắm mục tiêu đầu tiên cho KRAS đã được phê duyệt vào năm ngoái đối với bệnh ung thư phổi không phải tế bào nhỏ có đột biến KRAS G12C, nhưng chỉ có 2% bệnh ung thư tuyến tụy biểu hiện loại đột biến đó. Khoảng 36% bệnh ung thư tuyến tụy có đột biến KRAS là đột biến KRAS G12D.
Chất ức chế phân tử nhỏ được sử dụng trong nghiên cứu này, MRTX1133 (do Mirati Therapeutics phát triển) nhắm mục tiêu cụ thể đến KRAS G12D, như công ty đã báo cáo lần đầu tiên vào tháng trước trên tạp chí Nature Medicine.
Nghiên cứu của Penn hiện cho thấy chất ức chế KRAS không chỉ nhắm trực tiếp vào các tế bào ung thư mà còn hợp tác bất ngờ với hệ thống miễn dịch để tạo ra phản ứng lâu dài đối với việc điều trị.
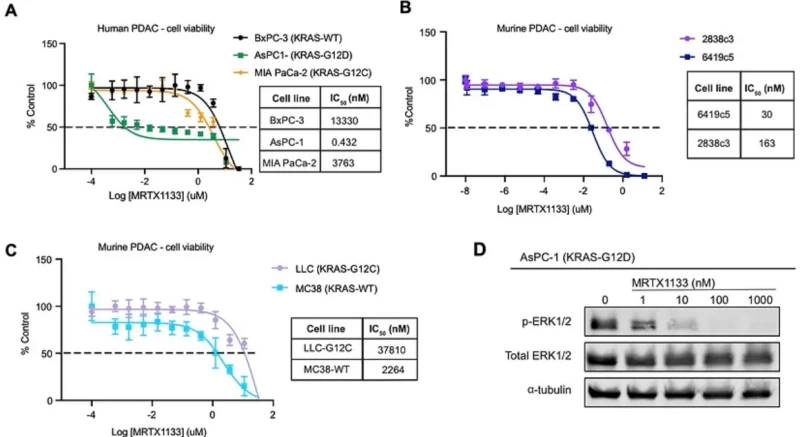 MRTX1133 ức chế chọn lọc KRASG12D và truyền tín hiệu MAPK xuôi dòng trong ống nghiệm. Phản ứng liều MRTX1133 của các tế bào BxPC-3 (KRASWT), AsPC-1 (KRASG12D) và MIA PaCa-2 (KRASG12C) sau 72 giờ điều trị. Pha loãng nối tiếp 3 lần đã được sử dụng và khả năng sống của tế bào được đo bằng CellTiter-Glo.
MRTX1133 ức chế chọn lọc KRASG12D và truyền tín hiệu MAPK xuôi dòng trong ống nghiệm. Phản ứng liều MRTX1133 của các tế bào BxPC-3 (KRASWT), AsPC-1 (KRASG12D) và MIA PaCa-2 (KRASG12C) sau 72 giờ điều trị. Pha loãng nối tiếp 3 lần đã được sử dụng và khả năng sống của tế bào được đo bằng CellTiter-Glo.
Stanger cho biết: “Từ các nghiên cứu KRAS G12C và các nghiên cứu trị liệu nhắm mục tiêu khác, chúng tôi biết rằng tình trạng kháng thuốc sẽ xảy ra. “Ngay cả trước khi tiến hành thử nghiệm lâm sàng, chúng tôi đã suy nghĩ về cách kết hợp các loại thuốc để các khối u không quay trở lại. Phát hiện của chúng tôi cung cấp bằng chứng cho thấy liệu pháp miễn dịch là một đối tác với chất ức chế KRAS G12D.”
Các nhà nghiên cứu đã có thể đánh giá tác động của MRTX1133 đối với hệ thống miễn dịch vì loại mô hình được sử dụng trong nghiên cứu cho phép khối u tự phát triển sau khi cấy vào chuột khỏe mạnh, giúp có thể phân biệt tác động của thuốc đối với môi trường vi mô xung quanh khối u ( TME).
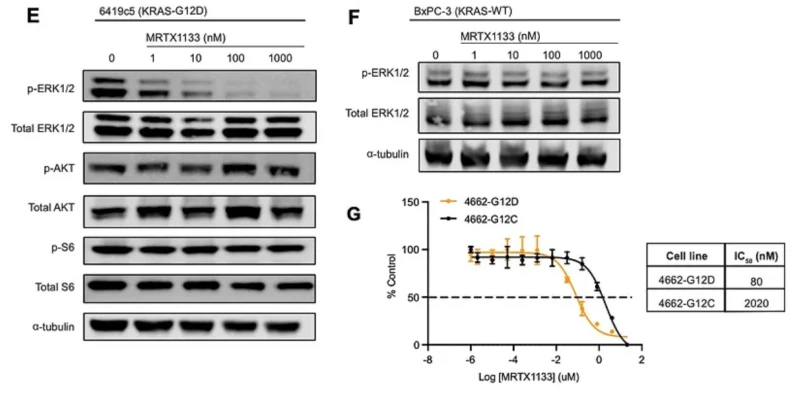 MRTX1133 ức chế chọn lọc KRASG12D và truyền tín hiệu MAPK xuôi dòng trong ống nghiệm. Đại diện phía tây của các tế bào ly giải từ các tế bào 6419c5 (KRASG12D) được xử lý bằng kiểm soát MRTX1133 hoặc DMSO trong hai giờ. Đại diện phía tây của các tế bào ly giải từ các tế bào BxPC-3 (KRAS-WT) được xử lý bằng kiểm soát MRTX1133 hoặc DMSO trong hai giờ. Phản ứng liều MRTX1133 của 4662-KRASG12D và 4662-KRASG12C sau 72 giờ xử lý. Pha loãng nối tiếp 5 lần đã được sử dụng.
MRTX1133 ức chế chọn lọc KRASG12D và truyền tín hiệu MAPK xuôi dòng trong ống nghiệm. Đại diện phía tây của các tế bào ly giải từ các tế bào 6419c5 (KRASG12D) được xử lý bằng kiểm soát MRTX1133 hoặc DMSO trong hai giờ. Đại diện phía tây của các tế bào ly giải từ các tế bào BxPC-3 (KRAS-WT) được xử lý bằng kiểm soát MRTX1133 hoặc DMSO trong hai giờ. Phản ứng liều MRTX1133 của 4662-KRASG12D và 4662-KRASG12C sau 72 giờ xử lý. Pha loãng nối tiếp 5 lần đã được sử dụng.
Mô hình KPC có khả năng miễn dịch được Penn Medicine phát triển gần 20 năm trước và là tiêu chuẩn vàng được sử dụng trên toàn thế giới để đánh giá các liệu pháp tiềm năng cho ung thư biểu mô tuyến ống tụy (PDAC). PDAC được biết là có TME đặc biệt dày đặc, góp phần kháng trị liệu.
Nhóm nghiên cứu phát hiện ra rằng loại thuốc này đã thúc đẩy sự gia tăng các tế bào T trong TME, giúp cải thiện độ sâu và thời gian phản ứng với MRTX1133. Tất cả sự thuyên giảm hoàn toàn được quan sát thấy trong nghiên cứu đều đi kèm với khả năng miễn dịch chống khối u qua trung gian tế bào T.
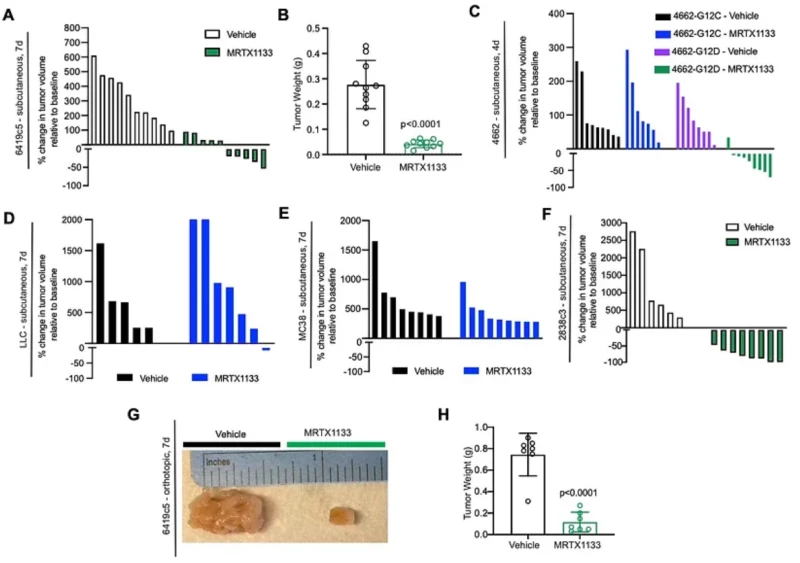 MRTX1133 được chọn lọc cho KRASG12D trong các mô hình khối u cấy ghép có khả năng miễn dịch. Biểu đồ dạng thác nước của phương tiện và khối u được điều trị bằng MRTX1133 (6419c5, tiêm dưới da) cho thấy sự thay đổi về thể tích khối u sau 7 ngày điều trị so với đường cơ sở vào ngày 0. Mỗi vạch đại diện cho một khối u. n=10 con chuột/nhóm.
MRTX1133 được chọn lọc cho KRASG12D trong các mô hình khối u cấy ghép có khả năng miễn dịch. Biểu đồ dạng thác nước của phương tiện và khối u được điều trị bằng MRTX1133 (6419c5, tiêm dưới da) cho thấy sự thay đổi về thể tích khối u sau 7 ngày điều trị so với đường cơ sở vào ngày 0. Mỗi vạch đại diện cho một khối u. n=10 con chuột/nhóm.
Ở những con chuột không có tế bào T, tác dụng của MRTX1133 rất ngắn và các khối u phát triển trở lại nhanh hơn nhiều. Những kết quả này cho thấy rằng MRTX1133 có thể được kết hợp với liệu pháp miễn dịch để cải thiện đáp ứng lâu dài với liệu pháp và ngăn ung thư quay trở lại.
Robert Vonderheide, MD, DPhil, giám đốc Abramson Cancer, đồng tác giả cho biết: “Sau nhiều năm làm việc để tìm ra các phương pháp mới rất cần thiết cho bệnh nhân ung thư tuyến tụy, thật thú vị khi có một loại thuốc mới đang được triển khai. Center và Giáo sư Trung tâm Ung thư John H. Glick Abramson tại Trường Y khoa Perelman, có các thành viên phòng thí nghiệm làm việc với những người trong phòng thí nghiệm của Stanger trong một nhóm hợp tác tập trung vào nghiên cứu này. “Chúng tôi lạc quan rằng các chất ức chế KRAS G12D sẽ sớm được đưa vào thử nghiệm lâm sàng. KRAS đang đầu hàng, và bây giờ chúng tôi biết hệ thống miễn dịch có thể nhìn thấy nó.”
Nghiên cứu được hỗ trợ bởi Viện Y tế Quốc gia (R01-CA229803, R01-CA252225, T32-CA009140 và P30-CA016520), Viện Nghiên cứu Ung thư (CRI4097), Viện Ung thư Parker












![[Review] iPad Pro 10.5 + Smart Keyboard đã làm mình muốn rời xa MacBook Pro](http://cdn.trangcongnghe.vn/thumb/160x240/2017-08/thumbs/review-ipad-pro-105-smart-keyboard-da-lam-minh-muon-roi-xa-macbook-pro_3.jpg)

